Принцип действия электрозащиты
Как известно из предыдущей статьи «Защита от коррозии» — потенциал защищаемого металла может быть изменен, если использовать внешний источник напряжения. Это составляет основу электрохимического метода защиты от коррозии (электрозащита).
Для того, чтобы наглядно увидеть действие электрозащиты целесообразно привести следующий эксперимент.
В стакан или небольшую стеклянную банку с раствором электролита поместите две небольшие стальные пластины. К пластинам подсоедините провода и соберите схему (см. рис. 1). Переменный резистор должен иметь сопротивление порядка 500-1000 Ом. В качестве источника напряжения 12 В можно использовать аккумуляторную батарею, или набор батареек. После того как все соединения выполнены, можно приступать к эксперименту. Левый по схеме электрод будет катодом, правый — анодом.
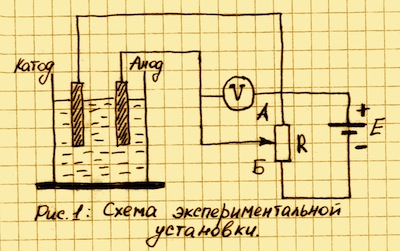
С помощью переменного резистора R можно изменять разность потенциалов между электродами, изменяя тем самым скорость коррозии защищаемого металла (катода). Разность потенциалов определяется с помощью вольтметра V.
При нахождении ползунка резистора в точке А разность потенциалов между электродами равна нулю, и оба металла корродируют с одинаковой скоростью. Процесс коррозии характеризуется довольно низкой скоростью и, вообще говоря, необходимо несколько дней, чтобы увидеть явные признаки ржавчины на металле.
Если передвигать ползунок резистора от точки А к точке Б, то разность потенциалов будет увеличиваться. При положительных показаниях вольтметра образуется защитный потенциал, который полностью остановит процесс коррозии катода. При этом можно будет наглядно наблюдать выделение водорода на катоде и процесс образования ржавчины на аноде. В данном случае анод, имеющий положительный потенциал, будет притягивать к себе гидроксильные группы (ОН) из раствора электролита и окислиться, а избыточные электроны под действием внешнего источника напряжения будут переходить на катод и восстанавливать его. Для увеличения скорости реакции достаточно растворить в банке с водой половину чайной ложки поваренной соли.
Теоретически, для полного прекращения коррозии, необходимо обеспечить защитный потенциал, равный стандартному электродному потенциалу защищаемого металла, который для железа равен 0,44 В. В действительности же различные включения в железо вызывают продолжение процесса коррозии. Для предотвращения этого явления необходимо дополнительно увеличить разность потенциалов между анодом и катодом.
Обращаясь вновь к экспериментальной установке, можно видеть, что с увеличением разности потенциалов резко возрастает интенсивность выделения водорода на катоде. Происходит это потому, что одновременно с увеличением разности потенциалов возрастает и ток между электродами, который и приводит к наблюдаемому эффекту.
Многочисленные исследования показали, что сила тока между электродами зависит от состояния защищаемой поверхности, в том числе от наличия защитного лакокрасочного покрытия и может изменяться от 0,05 мА (при хорошем состояние металла) до 10 мА (при нарушенном лакокрасочного покрытии) на каждый квадратный метр защищаемой поверхности. При этом максимальный защитный потенциал должен быть порядка 1В.